1-介绍
分子生物学这个领域,最初是从开发工具和方法中诞生的
工具包中的2个基本的东西
- 核酸内切酶
- 克隆载体
基因工程包括一系列活动(🍋梦回高中生物选修3)
随着研究进展,已经开发出越来越多灵敏地检测和扩增DNA的方法,进入全基因组测序时代
全基因组的功能和表达已经司空见惯
2-核酸酶
介绍
核酸酶是分子生物学实验室中最有价值的工具之一,尤其是限制性核酸内切酶,对克隆革命至关重要
核酸酶的功能是水解
- 核酸酶Nucleases水解:磷酸二酯键内的酯键
- 磷酸酶Phosphatases水解:单酯键中的酯键
磷酸酶在实验室中的作用
- 从多核苷酸链末端去除磷酸盐
- 对于后续的连接是必要的
核酸酶的分类
- endonucleases内切:内部
- exonucleases外切:末端
核酸酶具有多种特异性
- 有的特异于DNA
- 有的特异于RNA
- 有的可以作用于杂合体
- 有的只作用于单链
- 有的只作用于双链
核酸酶具有序列偏好性
- 有些优先在嘧啶之后切割
- 有些识别teeing的序列:
限制性核酸内切酶:将DNA切割成特定的片段
限制性内切酶必须做的2个事
- 识别特定序列
- 在该序列处切割
广义上存在3种不同的限制性内切酶
- 1型:位点不是回文,切割位点和识别位点远,1000bp
- 2型:位点是回文的,切割和识别位点相同
- 3型:位点不是回文,切割位点和识别位点,20-30bp
2型是最常见的
2型酶的识别和切割位点是相同的
位点长度4-8bp
特点:反向回文
切割方式
- 黏性末端
- 平末端
来自不同细菌的限制性内切酶可以具有相同的识别位点,但是切割方式(平or黏)不同,不同的酶被称为isoschizomers
restriction map
可以通过使用不同限制酶产生的片段之间的重叠来生成图谱
代表特定限制性内切酶找到其靶点标的位点的线性序列
DNA用不同内切酶切割时,被切割成不同的带负电荷片段
通过凝胶电泳根据大小分离
生成分子图谱
显示了切割DNA的位置
3-克隆
cloning定义
制作一个完全相同的副本 克隆DNA通常涉及重组DNA
载体DNA来源
- 质粒
- 病毒
载体设计的要求
- 安全
- 选择能力
- 高生长率
🌰蓝白选择载体(常见)
lacZ基因经过改造,包含一个多克隆位点(MCS),具有一系列不同的限制性内切酶识别位点,串联排列在与lacZ基因相同的阅读框中
如果克隆片段插入,lacZ基因将被破坏→蓝白斑
关于切割
- 载体和插入片段都用相同的限制酶切割
- 每端的末端不同,有助于控制插入物的方向
关于结合
- 插入:载体 = 5 :1 or 10 :1
- 过多过少都不行
- 连接的时候通常在冰上过夜,减缓连接反应产生更少的多聚体
转化Transformation
将DNA引入宿主细胞(大肠杆菌)
必须把DNA强迫进入宿主细胞
常见方法
- CaCl2高盐洗地
- 电流
大肠杆菌菌株的选择
- 不能把传进来的DNA进行甲基化
- 应该包含和lacZ互补的片段
常用:DH5𝛼
选择
在pool中选择想要的
去除
识别去除假阳性克隆(like仅载体而具体)
➪检查片段的大小(通过凝胶)
➪检查有无污染
4-克隆载体可以为不同的目的定制
克隆载体的来源
- 细菌质粒
- 噬菌体
- 粘粒
- 酵母人工染色体
穿梭shuttle载体
可以在不止一种类型的宿主细胞中传播
表达载体
包含允许任何克隆基因转录的启动子
报告基因
可以用来测量启动子的活性or组织特异性的表现
最合适的报告基因类型取决于我们是否有兴趣量化启动子的效率or确定其组织-特定的表达方式
可用于可视化基因表达模式的最受欢迎的是绿色荧光蛋白GFP
还有很多不同颜色的变体,用来可视化
存在许多将DNA引入靶细胞的方法
- 不同生物使用不同的方法
5-核酸检测
经典方法:核酸吸收260nm光的能力
- 吸收光的量与核酸量成正比
- 单链和双链不同
- DNA和RNA不同
- 和蛋白质(280nm)不同
可视化方法:溴化乙锭非特异染色
- EtBr嵌入堆叠碱基对之间的双螺旋中
- 强诱变剂(不安全)
- 紫外线下荧光
检验特定的核酸序列:通过标记的核酸与互补序列的杂交鉴定
- 设计探针(单链,通常是DNA)
- 目标:单链or双链,DNA(southern)or RNA(Northern)
- 影响稳定性的变量:
- GC%
- 外在:温度、浓度等等
- 场所:
- 溶液
- 靶标与膜支持物
探针的放射标记方法:
- 放射性
- 末端标记
- Klenow DNA 聚合酶
- 荧光
- FISH
- 比色
- digosygenin-labeled
洗涤
- 去除未与互补核酸特异性结合的探针
- 严格(温度、浓度)
6-DNA 分离技术
大多构成生物体基因组的单个DNA片段长度数量级Mb➠物理上太大在实验室难以操作
单个gene小、容易管理,数据级百or千bp
第一步:将原始大片段分解成小片段,分离出感兴趣的部分
机械剪切:随机产生断裂
1. 凝胶电泳
2. 密度梯度离心
基于大小分离和可视化DNA分子的最简单的方法:凝胶电泳
- 中性琼脂糖凝胶or聚丙烯酰胺(分辨率更高)
- 导电的弱碱性缓冲液
- 直流电
- 大小:短的DNA片段跑的快
- 形状:紧凑的DNA片段跑得快
从其他生物分子中分离出DNA:密度梯度离心
- 超速离心
7-DNA测序
- 第一代
- 第二代
- 第三代

8-PCR和RT-PCR
【TODO】
聚合酶链式反应,指数
PCR: DNA
RT- PCR: RNA→DNA
关于引物
- 体内:DNA引物酶提供的短RNA
步骤:
扩增子
引物设计考虑
- DNA二级结构
- 序列唯一性
- 引物间Tm相似等问题
PCR产物的检测可以通过多种方式
- 凝胶电泳
- 特异性染色
实时PCR
直接检测反应容器中产生的扩增子
通过光学的方法
➠显示出threshold cycle(Ct)与起始模版之间良好的相关性
qPCR(定量PCR)
实时PCR检测的最简单方法是使用在双链DNA存在时选择性结合并发出荧光的染料
潜在问题:report 染料不是特异性的,可能假阳性
替代方法
荧光共振能量转移(FRET)
FRET仅仅在报告基团和猝灭剂荧光团非常接近时发生
可以检测序列特异性扩增子的产生
精心优化Tm➠最大限度提高灵敏度和扩增动力学,保证引物精确匹配
聚合酶来自火山细菌
💡关键发现可能来自最意想不到的探索途径
9-Blotting方法
Southern ➜ DNA
Northern ➜ RNA
Western ➜ Pr
在凝胶基质中按大小分离核酸后
- 可以通过非特异性染料检测
- 可以通过blotting特异性检测
- 缺点:慢
- 优点:灵敏、特异、定量
Southern blotting
步骤

变体
- 二维凝胶:按形状和大小分离
Northern blotting

Western blotting

10-DNA微阵列
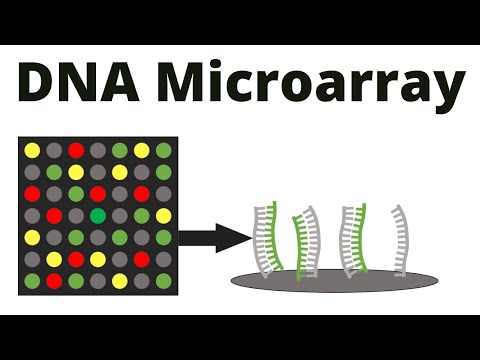
来自 Southern 和 Northern 印迹的技术进步是微阵列。
这不是将未知样品放在膜上而将探针放在溶液中,而是有效地逆转了两者。
这些起源于“slot-blots”或“dot-blots”的形式,研究人员可以将感兴趣的单个 DNA 序列以有序模式直接定位到杂交膜上,每个点由不同的、单一的、已知的序列组成
膜的干燥固定了这些斑点,形成了预制的印迹阵列。
在使用中,研究人员随后会采集感兴趣的核酸样本,例如总细胞 DNA,然后将其片段化并随机均匀地标记该 DNA(最初使用放射性同位素标记)。
然后可以像在 Southern 印迹中一样使用这种标记的样本 DNA 混合物作为探针与预制印迹杂交。
与任何阵列点同源的标记DNA序列将杂交并保留在该点的已知固定位置并通过放射自显影术显现。通过查看放射自显影图并了解每个特定探针点的物理位置,可以读出杂交与非杂交点的模式,以指示未知样品中每个相应的已知序列的存在或不存在。
技术进步
这种方法的技术改进很快通过固定点的尺寸和物理密度的小型化,从具有 30 到 100 个点的膜到具有多达 1,000 个点的玻璃显微镜载玻片。
现在,硅芯片基板在大约一张邮票大小的区域内有数十万甚至一百万或更多的单独点。
为了使这种高密度阵列中的不同点可视化,使用了自动光学显微镜,并且荧光已经取代了放射性标记,以提高空间分辨率(更高的点密度)和更容易量化每个杂交信号。
随着每个阵列的点总数增加,每个独特探针的长度通常变得更短,从而允许阵列中的每个点对较小的目标区域具有特异性
实际上,在分子上提供更大的“分辨率”规模。尽管微阵列的潜在应用实际上仅受用户想象力的限制,但它们已成为许多特定应用的标准工具。
1⃣️基因表达谱
用于检测样本中所有表达基因的水屁股
过程:
收集来自感兴趣样本的总 mRNA 样本,并通过随机引发的逆转录将其整体转化为 cDNA。
在合成过程中将标记掺入 cDNA
- 这可以是荧光团(“直接标记”)
- 或另一种半抗原(例如生物素)
然后将该标记的 cDNA 与阵列杂交,其中固定点由与来自靶生物的许多已知 mRNA 的互补链组成。杂交、洗涤和可视化允许检测已结合其互补标记 cDNA 的那些点,从而读出原始样品中正在表达的基因。
这种方法是相当定量的,这意味着在每个点上观察到的信号相当好地对应于其特定 mRNA 的原始水平。
巧妙地选择每个固定点的序列(例如选择与基因的特定交替外显子互补的短探针序列)
甚至可以允许该方法区分和定量来自单个基因的交替剪接产物的相对水平。
通过比较在实验组织和对照组织上并行执行的此类实验的数据,实验可以收集基因表达模式的总细胞“全局”变化的快照,通常对实验组织的状态或状况有有用的洞察力
mRNA 从对照和实验细胞或组织中分离出来,并在荧光标记的核苷酸(或引物)存在下进行逆转录,从而为每个样品产生具有不同荧光团(红色和绿色链)的标记 cDNA。
红色和绿色 cDNA 与微阵列的竞争性杂交与两个样品中每种 mRNA 的相对丰度成正比。
红色和绿色荧光的相对水平通过显微扫描测量并显示为单一颜色。
- 红色或橙色表示实验样品中的表达增加
- 绿色或黄绿色表示较低的表达
- 黄色表示对照和实验中相同水平的表达。
2⃣️基因分型
单核苷酸阵列允许对单核苷酸多态性进行全基因组基因分型
对人类基因组(和其他生物体)的分析导致大量单核苷酸多态性的鉴定。
单个 SNP 以已知频率出现,这在人群之间通常不同。
最直接的例子是 SNP 在感兴趣的基因中产生错义突变(例如参与药物代谢的基因)
携带 SNP 的一个等位基因的人可能会以与具有替代等位基因的人非常不同的速率从循环中清除药物,因此确定患者在该 SNP 的等位基因可能是选择合适的药物剂量时的重要考虑因素。
🌰一个例子是 CYP450 SNP 基因分型以确定抗凝剂华法林的适当剂量。
🌰另一个是在某些类型的癌症患者中对 K-Ras 致癌基因进行 SNP 基因分型,以确定 EGFR 抑制药物是否具有治疗价值。
其他 SNP 可能没有直接的生物学后果,但如果发现与特定的感兴趣的等位基因密切相关,即如果在遗传方面密切相关,则可以成为有价值的遗传标记。
数十万个 SNP 已被映射到人类基因组中,并且可以用受试者的 DNA 探测的阵列允许同时确定每个 SNP 的基因型,同时确定相关的遗传等位基因是什么。
实际上,与实际对整个受试者基因组进行测序相比,这允许从单个实验中推断出受试者的大部分基因型,而时间和费用要少得多。
然而,展望未来,应该注意 SNP 基因分型(在连锁等位基因而不是直接错义突变等位基因的常见情况下)是间接推断,至少有一些不准确的可能性。
另一方面,测序是确定的。如果新兴的测序技术改进到可以在 24 小时内提供完整的人类基因组,从而使 SNP 基因分型具有竞争力的成本,它可能会成为基因分型的主要方法。
3⃣️阵列比较基因杂交array-CGH
是一种增强or替代细胞遗传学的技术
作用:
用于检测和定位改变给定序列拷贝数的染色体异常(即缺失或重复)
在这项技术中,被称为平铺阵列的阵列芯片上点有生物体的基因组序列,这些基因组序列共同代表整个基因组。阵列的密度越高,每个点代表的遗传区域越小,因此分析可以提供的分辨率越高。
两个 DNA 样本(一个来自正常对照组织,一个来自感兴趣的组织)每个都用不同的荧光团随机标记,例如,一个样本是绿色的,另一个是红色的。
这两个不同标记的样本以完全相等的总 DNA 比例混合,然后与芯片杂交。
在两个样本中同样出现的 DNA 区域将与其互补的阵列点杂交,从而产生“混合”颜色信号。
相比之下,在一个样本中比另一个样本中出现更多的任何 DNA 区域将胜过竞争,因此在它们的互补探针点上显示出比缺陷样本更强烈的颜色。
计算机辅助图像分析可以读取和量化每个阵列点上的微小颜色变化,从而检测测试样本中甚至非常小的区域的半合子丢失或重复。
与传统细胞遗传学相比,该技术提供的自动化分辨率和便利性导致其在诊断环境中越来越多地被采用,以检测与一系列遗传性疾病相关的染色体拷贝数变化。
4⃣️平铺阵列
作用
染色质免疫沉淀研究
除了所描述的类似芯片的固相阵列,用于重点应用的低密度阵列(多达几百个目标,而不是数百万个)可以基于微珠的形式制造。
在这些方法中,每个微珠都有不同的光学信号或代码,其表面可以涂有目标 DNA 序列。不同的磁珠代码可以混合并匹配到单个标记的 DNA 或 cDNA 样本中,然后通过光学和/或流式分选方法进行分类、检测和定量。尽管密度比芯片型阵列低得多,但珠阵列可以更容易地修改和调整以适应特定的重点生物学问题,并且在实践中它们显示出比芯片更快的三维杂交动力学,芯片实际上具有二维动力学.
11-染色质免疫沉淀
作用:
染色质免疫沉淀可以检测体内特定的蛋白质-DNA 相互作用。
ChIP-seq允许在整个基因组中绘制给定蛋白质的所有蛋白质结合位点
到目前为止,本章讨论的大多数方法都是体外方法,可以检测或操作从细胞中分离or合成的核酸或蛋白质。
然而,已经开发了许多其他强大的分子技术
- 这些技术要么允许直接可视化大分子的体内行为
- 要么允许研究人员在特定条件或时间点对大分子的体内定位或相互作用进行“快照”
有许多蛋白质通过直接与 DNA 相互作用而发挥作用
尽管我们对这些过程的大部分理解来自体外重组实验,但绘制活细胞中蛋白质-DNA 相互作用的动态图以充分理解这些复杂的功能至关重要。
开发了强大的染色质免疫沉淀 (ChIP) 技术来捕获这种相互作用。
ChIP 允许研究人员检测体内特定 DNA 序列中是否存在任何感兴趣的蛋白质
染色质免疫沉淀检测体内天然染色质环境中的蛋白质-DNA 相互作用。
蛋白质和 DNA 交联,染色质被分解成小片段,抗体用于免疫沉淀感兴趣的蛋白质。然后通过 PCR 识别特定序列或通过标记 DNA 并应用于平铺阵列以检测全基因组相互作用来纯化和分析相关的 DNA。
步骤
ChIP 的第一步通常是通过用甲醛固定感兴趣的细胞(或组织或有机体)来交联。
这有两个目的
- 它杀死细胞并在固定时阻止所有正在进行的过程,提供细胞活动的快照
- 它共价连接任何非常接近的蛋白质和 DNA,从而通过后续分析保持蛋白质-DNA 相互作用
ChIP 可以在不同实验条件下对细胞或组织进行,以寻找不同条件下蛋白质-DNA 相互作用的变化
12-基因敲除和基因编辑
转基因
通过添加外源 DNA 获得新遗传信息的生物被称为转基因生物。
对于简单的生物体,如细菌或酵母,很容易通过用含有感兴趣序列的 DNA 构建体进行转化来产生转基因。
然而,多细胞生物中的转基因可能更具挑战性。
基因敲除
研究基因功能的一种更通用的方法是消除感兴趣的基因。转基因方法允许将 DNA 添加到细胞或动物中
但要了解基因的功能,最有用的是能够去除基因或其功能并观察产生的表型。
改变基因组的最强大技术使用基因靶向来通过同源重组删除或替换基因。基因缺失通常称为敲除,而用替代突变版本替换基因称为敲入。
基因编辑
